FDW254PZ存在大量电子及原子轨道
发布时间:2018/12/21 20:54:51 访问次数:2432
有很多原子的分子中,FDW254PZ存在大量电子及原子轨道,其简并程度很高。在量子力学计算过程中,非常复杂。为了简化处理多电子系统,有必要将分子中每个原子的电子轨道(即原子轨道)结合在-起考虑,形成分子中的电子轨道(即分子轨道),由此发展出分子轨道理论。分子轨道理论认为:①分子中每一个电子的运动是在核和其余电子的平均势场中的运动,它的运动状态可用单电子波函数¢来描述。这种分子中描述单电子运动的波函数称为分子轨道.以¢函数表示。②分子轨道可用原子轨道的线性组合(linear∞mbh耐o11of耐o血c Orbitals,LCAo)来表示。量子力学计算证明,价键轨
道的数目必须守恒,即形成分子轨道的数目与参加成键的原子轨道数目相同。根据能量的高低,分子轨道可分为成键轨道和反键轨道。成键轨道的能量低于原来的原子轨道能量,反键轨道的能量高于原来的原子轨道的能量。③分子中的电子根据能量最低原理和泡利Cauli)不相容原理排布在分子轨道上。④不同原子轨道有效组成分子轨道必须满足一定的条件,即能量相近、轨道最大重叠和对称性匹配这三个条件。
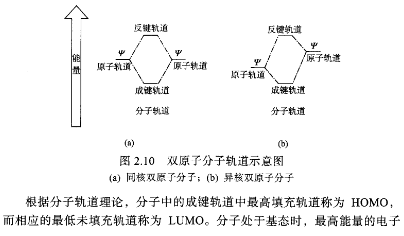
图2.I0给出由双原子轨道组成的分子轨道示意图,⑶为同核双原子形成的分子轨道;o)为异核双原子形成的分子轨道。图2.10⑴表示,当两个相同的原子距离足够近时,它们的电子云会重叠,原子中与电子云重叠相关的两个电子轨道,在孤立时是处于相同的能级位置,由于电子云的重叠使它们发生重新组合,产生两个新轨道,其中的一个轨道在原来轨道的下方,具有较低能量,是成键轨道;而另一个在原轨道的上方,具有较高能量,是反键轨道。图2.10(b)表示,当两个轨道能量不等的原子轨道形成分子轨道时,根据能量相近原则,成键分子轨道的能量将接近能量较低的原子轨道能量,而反键分子轨道则靠近能量较高的原子轨道。根据分子轨道理论中价键轨道数目必须守恒原则,考虑由两个氢原子形成氢气分子的情形:当两个原子足够近时,它们的1s轨道重叠,在两个原子的周围会形成两个σ键。与孤立原子的轨道相比,一个分子轨道中电子的能量较低,是
成键轨道,而另一个分子轨道中电子的能量较高,是反键轨道。通常地,氢气分子中的一对电子分布在成键轨道上。与氢原子相比,分子中电子的能量降低了。将理论扩展到有许多原子的固体中,由于多个原子的相互作用,产生了能级分裂的分子轨道,数目与参与成键的原子轨道数相同。如果固体中含有Ⅳ个电子相互作用,则可产生Ⅳ个分子轨道,其能级包括简并的和分裂的两种情形。但是,这些分裂出来的轨道能级差别很小,可形成连续能带。有关分子轨道理论详尽的推导与解释请参见相关的结构化学书籍。
有很多原子的分子中,FDW254PZ存在大量电子及原子轨道,其简并程度很高。在量子力学计算过程中,非常复杂。为了简化处理多电子系统,有必要将分子中每个原子的电子轨道(即原子轨道)结合在-起考虑,形成分子中的电子轨道(即分子轨道),由此发展出分子轨道理论。分子轨道理论认为:①分子中每一个电子的运动是在核和其余电子的平均势场中的运动,它的运动状态可用单电子波函数¢来描述。这种分子中描述单电子运动的波函数称为分子轨道.以¢函数表示。②分子轨道可用原子轨道的线性组合(linear∞mbh耐o11of耐o血c Orbitals,LCAo)来表示。量子力学计算证明,价键轨
道的数目必须守恒,即形成分子轨道的数目与参加成键的原子轨道数目相同。根据能量的高低,分子轨道可分为成键轨道和反键轨道。成键轨道的能量低于原来的原子轨道能量,反键轨道的能量高于原来的原子轨道的能量。③分子中的电子根据能量最低原理和泡利Cauli)不相容原理排布在分子轨道上。④不同原子轨道有效组成分子轨道必须满足一定的条件,即能量相近、轨道最大重叠和对称性匹配这三个条件。

图2.I0给出由双原子轨道组成的分子轨道示意图,⑶为同核双原子形成的分子轨道;o)为异核双原子形成的分子轨道。图2.10⑴表示,当两个相同的原子距离足够近时,它们的电子云会重叠,原子中与电子云重叠相关的两个电子轨道,在孤立时是处于相同的能级位置,由于电子云的重叠使它们发生重新组合,产生两个新轨道,其中的一个轨道在原来轨道的下方,具有较低能量,是成键轨道;而另一个在原轨道的上方,具有较高能量,是反键轨道。图2.10(b)表示,当两个轨道能量不等的原子轨道形成分子轨道时,根据能量相近原则,成键分子轨道的能量将接近能量较低的原子轨道能量,而反键分子轨道则靠近能量较高的原子轨道。根据分子轨道理论中价键轨道数目必须守恒原则,考虑由两个氢原子形成氢气分子的情形:当两个原子足够近时,它们的1s轨道重叠,在两个原子的周围会形成两个σ键。与孤立原子的轨道相比,一个分子轨道中电子的能量较低,是
成键轨道,而另一个分子轨道中电子的能量较高,是反键轨道。通常地,氢气分子中的一对电子分布在成键轨道上。与氢原子相比,分子中电子的能量降低了。将理论扩展到有许多原子的固体中,由于多个原子的相互作用,产生了能级分裂的分子轨道,数目与参与成键的原子轨道数相同。如果固体中含有Ⅳ个电子相互作用,则可产生Ⅳ个分子轨道,其能级包括简并的和分裂的两种情形。但是,这些分裂出来的轨道能级差别很小,可形成连续能带。有关分子轨道理论详尽的推导与解释请参见相关的结构化学书籍。
 热门点击
热门点击

 公网安备44030402000607
公网安备44030402000607





